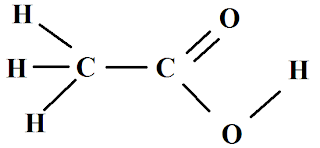A área "Escolha do Solvente" já foi corrigida e está pronta para ser utilizada. As regiões de vermelho correspondem às partes que foram retiradas ou consertadas. [20/05/2013, às 06:05]
Mais algumas alterações foram feitas, sendo essas feitas com cor roxa. [24/06/2013]
Datas em que a experiência foi realizada: 09, 16 e 30 de abril de 2012
SUMÁRIO
1. Objetivo
2. Introdução
3. Materiais
4. Procedimentos
·
Escolha do Solvente
·
Recristalização
·
Determinação do Rendimento e do Ponto
de Fusão
5. Resultados
e Discussões
5.1.
Escolha do Solvente
5.2.
Recristalização
5.3.
Determinação do Rendimento e do Ponto de
Fusão
6. Conclusão
7. Anexos
8. Referências
1.
Objetivo
Purificar
uma substância através do método da recristalização e comprovar a eficiência de
tal através da obtenção de seu rendimento e do ponto de fusão do
recristalizado.
2.
Introdução [INCOMPLETA]
- Falta falar mais sobre como se dá a recristalização (de forma sintetizada), enumeração de etapas, etc.
- Falta falar mais sobre como se dá a recristalização (de forma sintetizada), enumeração de etapas, etc.
Apesar de ser mais fácil
de se encontrar espécies químicas agrupadas umas as outras na natureza e seu
estudo ser mais denso na Química, a pureza também é de fundamental importância.
É graças a ela que se pode obter as propriedades específicas, responsáveis pela
diferenciação de uma substância da outra e sua possível interferência no
momento em que a mesma se mistura / reage com outra. Elas são: ponto de fusão,
ponto de ebulição, densidade, calor específico, solubilidade, viscosidade,
dentre outras.
Tendo em conta que a substância pura está “isolada”, fica
mais fácil assim de se ter uma melhor visualização de suas propriedades
físico-químicas e, por conseguinte, de conhecer sua melhor utilização. No
entanto, para obter um material no seu estado puro é necessário primeiro uma
série de procedimentos. Dentre os principais tem-se: extração, recristalização,
destilação e cromatografia. Como no caso em questão foram utilizados somente sólidos,
a melhor operação para purificação dos mesmos é a recristalização, processo em
que se tem por finalidade obter um sólido cristalino com alto grau de pureza.
Outro ponto a se observar é que como tal prática tem como
objetivo apenas a purificação através da separação das impurezas de um sólido,
não ocorrerá nenhuma reação química. O que ocorre em si são somente operações
físicas para que se obtenha o sólido puro no final na forma de cristal. A
recristalização pode ser usada tanto em laboratórios direcionados à Química Inorgânica
quanto nos de Orgânica.
O sólido a ser recristalizado, o ácido benzoico (fórmula
molecular: C7H6O2
ou C6H5COOH), é o ácido carboxílico (sufixo -oico)
e aromático (contém anel benzênico) de estrutura mais simples. Em sua forma
pura é um sólido branco, cristalino, praticamente insolúvel em água (2,9 g/L a
25°C) e de ponto de fusão de 122ºC. Solúvel em solventes orgânicos pouco
polares, seu nome oficial é ácido-benzeno-monocarboxílico e ,por possuir ação
fungicida, é utilizado na conservação de alimentos e na produção de produtos farmacêuticos e cosméticos.
A partir dos preceitos citados acima e da caracterização do
ácido benzoico é que a purificação pelo método de recristalização e
identificação da substância pôde ser feita.
3.
Materiais
[Os solventes devem estar separados dos outros materiais, já que mesmo sem reagir, eles são considerados como "reagentes comuns de laboratório"]
[Os solventes devem estar separados dos outros materiais, já que mesmo sem reagir, eles são considerados como "reagentes comuns de laboratório"]
ESCOLHA DO SOLVENTE
TABELA 1: Componentes da etapa 1 da Experiência: Escolha do
Solvente
MATERIAIS
E VIDRARIAS
|
||
TIPO
|
QUANTIDADE
|
CAPACIDADE
|
Ácido Benzoico
|
0,414g
|
-
|
Tubo de Ensaio
|
4
|
Qualquer
|
Pipeta Pasteur
|
4
|
5mL
|
Béquer
|
4
|
Qualquer
|
Ácido Acético
|
1 a 3mL
|
-
|
Acetato de Etila
|
1 a 3mL
|
-
|
Álcool Etílico
|
1 a 3mL
|
-
|
Água destilada
|
1 a 3mL
|
-
|
Placa de Aquecimento com agitador
magnético
|
1
|
-
|
Barra Magnética
|
1
|
-
|
Suporte Universal
|
1
|
-
|
Garra
|
1
|
-
|
RECRISTALIZAÇÃO - TABELA
2: Componentes da etapa 2 da Experiência: Recristalização
MATERIAIS
E VIDRARIAS
|
||
TIPO
|
QUANTIDADE
|
CAPACIDADE
|
Ácido Benzoico
|
1,9992g
|
-
|
Erlenmeyer
|
2
|
250mL
|
Água destilada
|
aprox.
100mL
|
-
|
Placa de Aquecimento com agitador
magnético
|
1
|
-
|
Barra Magnética
|
1
|
-
|
Carvão ativado (opcional)
|
Porção
pequena
|
-
|
Funil simples sem bico
|
1
|
-
|
Papel de filtro qualitativo
|
1
|
-
|
Béquer (largo)
|
1
|
Maior
possível
|
Cubo de Gelo
|
7
|
-
|
Vidro de Relógio
|
1
|
-
|
Funil de Buchner
|
1
|
-
|
Kitasato
|
1
|
-
|
Mangueira
|
2
|
-
|
Bomba de vácuo
|
1
|
-
|
Frasco de Segurança
|
1
|
-
|
Balança Analítica
|
1
|
-
|
Pinça
|
1
|
-
|
Suporte Universal
|
1
|
-
|
Garra
|
1
|
-
|
Rolha de borracha
|
1
|
-
|
DETERMINAÇÃO DO
RENDIMENTO E PONTO DE FUSÃO
Tabela 3: Componentes da etapa 3 da experiência: Micro
determinação do ponto de fusão
MATERIAIS
E VIDRARIAS
|
||
TIPO
|
QUANTIDADE
|
CAPACIDADE
|
Cápsula de Porcelana
|
1
|
-
|
Balança Analítica
|
1
|
-
|
Bastão de Vidro
|
1
|
-
|
Tubo capilar
|
1
|
Pequena
|
Papel de filtro
|
1
|
-
|
Ácido Benzoico
|
aprox.
1g
|
-
|
Termômetro
|
1
|
-
|
Anel de borracha
|
1
|
-
|
Suporte Universal
|
1
|
-
|
Béquer
|
1
|
50mL
|
Placa de aquecimento com agitador
magnético
|
1
|
-
|
Barra magnética
|
1
|
-
|
Glicerina
|
aprox.
40mL
|
-
|
Para visualizar o sistema montado, vide anexos.
1.
Procedimentos
· Escolha do Solvente
1 – Colocou-se uma quantidade de cerca
de 0,1g (100mg) de ácido benzoico puro em quatro tubos de ensaio e adicionou-se
cada solvente (Ácido acético, acetato de etila, álcool etílico e água
destilada) gota a gota em cada tubo, agitando-se a mistura.
2 – Após a adição de cerca de 1 a 3mL
de cada solvente a temperatura ambiente, observou-se se todo o sólido ou grande
parte dele se dissolveu a frio. Caso sim, o solvente não servia. Caso não,
aqueceu-se o tubo de ensaio sob aquecimento constante em um banho de glicerina na
placa de aquecimento.
3 – Caso solubilizasse a quente,
deixou-se a solução esfriar lentamente. Se houvesse formação de cristais, esse
era o solvente adequado.
· Recristalização
1-Pesou-se aproximadamente 2g de acido
benzoico com impurezas e o papel de filtro que seria utilizado para a filtração
a vácuo.
2-Colocou-se o ácido benzoico junto com
uma barra magnética em um erlenmeyer de 250mL.
3-Adicionou-se 100mL aproximadamente de
água destilada ao erlenmeyer.
4-Aqueceu-se a mistura em uma placa de
aquecimento até a dissolução do ácido benzoico a quente até atingir temperatura
próxima a do ponto de ebulição da água. Acima desse sistema, colocou-se um
funil sem bico para posterior filtração [vide anexos]. OBS: Opcionalmente,
costuma-se colocar carvão ativado na mistura caso a mesma permaneça colorida.
5-Preparou-se um papel de filtro
pregueado
6- Submeteu-se o sistema ácido benzoico
+ água à filtração (à quente) por gravidade. Abaixo do sistema de filtração
colocou-se um segundo erlenmeyer de 250mL.
7-Cobriu-se o erlenmeyer com um vidro
de relógio após a filtração e deixou-se em repouso à temperatura ambiente até
esfriar
8- Colocou-se o erlenmeyer contendo o
ácido benzoico e água em um béquer largo contendo 2 dedos de água e 7 cubos de
gelo..
9-Montou-se o sistema de filtração a
vácuo [vide anexos] e submeteu-se a tal processo a mistura resfriada.
10-Após filtrar os cristais mais uma
vez, guardou-se o papel de filtro contendo o ácido benzoico em um armário.
· Determinação do
Rendimento e do Ponto de Fusão
1-Pesou-se o papel de filtro contendo
os cristais do ácido benzoico.
2-Calculou-se o rendimento da
recristalização baseando-se na regra de três:
Massa do ácido benzoico inicial
---------- 100%
Massa dos cristais do ácido benzoico
---- X
3-Pulverizou-se os cristais do ácido
benzoico em uma capsula de porcelana com o auxílio de um bastão de vidro.
4-Colocou-se o ácido no tubo capilar
através da técnica de empacotamento, ou seja, bateu-se sua abertura contra o
papel de filtro na qual continha a substância. Para que a mesma caisse para o
fundo, foi necessário bater também a parte fechada contra a mesa.
5-Montou-se o sistema de Siwoloboff
[rever anexos] tomando-se o cuidado de tomar duas medidas características: a do
começo da fusão – quando os cristais do ácido formam gotas e resquícios do
sólido ficam dispersos na fase líquida – e o término da fusão – temperatura na
qual a substância se torna inteiramente líquida.
6 – Após ter-se obtido o possível ponto
de fusão, esperou-se o resfriamento de 10 a 15ºC abaixando-se a temperatura da
placa e anulando a agitação. Repetiu-se o procedimento mais uma vez.
Comparou-se os resultados obtidos à literatura.
2.
Resultados e Discussões
·
5.1 - Escolha
do Solvente
Antes de mais nada, para que a recristalização do ácido benzoico pudesse
ser efetuada de maneira correta era necessário que o solvente fosse apropriado para
a formação dos cristais. É de caráter essencial que o solvente assuma as
seguintes características: Não reaja com o soluto; solubilize muito pouco a
frio, mas por completo a quente (com a finalidade de se formar uma solução supersaturada para posterior precipitação de soluto, que no caso em questão sairá em formato de cristais); seja capaz de solubilizar as impurezas
contidas no soluto a frio (os cristais são formados a frio); seja facilmente
removível dos cristais e, de preferência, de baixos custo, toxicidade e
inflamabilidade (visto que será utilizado calor).
Nesta etapa foram fornecidos quatro solventes principais: Ácido acético, acetato de etila, álcool etílico e agua. A partir da simples adição dos mesmos ao ácido benzoico puro pôde-se perceber as seguintes características:
Nesta etapa foram fornecidos quatro solventes principais: Ácido acético, acetato de etila, álcool etílico e agua. A partir da simples adição dos mesmos ao ácido benzoico puro pôde-se perceber as seguintes características:
Tabela 4. Teste com solventes
Solvente
|
Solubilidade
|
Classificação do Solvente
|
|
A frio
|
A quente
|
||
Ácido acético
|
Muito solúvel
|
Não testada
|
Inadequado
|
Acetato de Etila
|
Muito solúvel
|
Não testada
|
Inadequado
|
Álcool etílico
|
Muito solúvel
|
Não testada
|
Inadequado
|
Água destilada
|
Pouco solúvel
|
Solúvel
|
Adequado, formou cristais
|
A partir de tal observação
pode-se definir que a água destilada é o melhor solvente de recristalização do
ácido benzoico pois dentre os quatro, foi o único a dissolver apenas a quente.
Além disso, é fácil de ser removido através de sua ebulição (seu ponto de
ebulição é menor do que a fusão do ácido benzoico), é um solvente de baixo
custo e de toxicidade e inflamabilidade nulas.
Caso o único solvente adequado
fosse tóxico ou caro, teria-se que utilizar a técnica de refluxo para que o
mesmo não fosse inalado ou desperdiçado. Caso o ácido benzoico fosse solúvel em
um solvente e insolúvel em outro, teria-se a opção de misturá-los em
determinadas proporções de tal forma que caso a mistura entre os dois fosse
homogênea, proporcionasse características intermediárias à mistura resultante, possibilitando seu uso na
recristalização.
Analisando-se as fórmulas estruturais (sem pares de elétrons livres)
pode-se ver o porque da afinidade ou desafinidade dos solventes utilizados com
o ácido benzoico a frio:
Figura 1. Fórmula estrutural total e resumida do
ácido benzoico
Figura 2. Fórmula Estrutural do Ácido Etanoico
(Acético)
Figura 3. Fórmula Estrutural do Acetato de Etila
Figura 4. Fórmula Estrutural do Álcool Etílico
Figura 5. Fórmula Estrutural da Água destilada
Fórmulas moleculares:
v Ácido Benzoico = C7H6O2
ou C6H5COOH
v Ácido Acetico = H3CCOOH
v Acetato de Etila = C4H8O2
ou H3C-C=OO-CH2-CH3
v Álcool Etílico = H3C-CH2-OH
ou C2H6O
v Água destilada = H2O
ou H-OH
Principais razões
para a solubilidade ou não:
No caso do ácido acetico se tornou evidente que a alta solubilidade a
frio aconteceu devido as moléculas possuirem estruturas bastante parecidas, o mesmo
grupo funcional e ambas possuirem uma parte polar (com hidroxila) e outra parte
apolar (ligações C-H) facilitando a interação entre as duas moléculas e, por
conseguinte, a solvatação das moléculas do soluto pelas do solvente.
No tubo em que foi adicionado o acetato de etila também percebeu-se
muita solubilidade a frio, mesmo com o ácido benzoico pertencendo a função
ácido carboxílico e o acetato de etila à função estér. Isso se deu devido ao
fato de ambas as substâncias possuirem uma parte polar (OH no caso do ácido benzoico e os oxigênios do acetato de etila) e uma parte apolar
(cadeia carbônica). e pelo acetato de etila ser um composto orgânico de cadeia curta. Essa situação prova que
não importa se duas substâncias são de funções orgânicas diferentes ou não. O fator preponderante para avaliar a solubilidade de compostos orgânicos é a polaridade e o tamanho da cadeia carbônica. Nesse caso assim como o anterior houve solvatação normalmente.
Com o álcool etílico também não foi diferente. Por possui uma cadeia de
apenas 2 carbonos, sua parte apolar (cadeia carbônica) não é tão grande comparada com a parte
polar (contém um grupo hidroxila). Isso faz com que a mesma solubilize fácil a
frio tanto o ácido benzoico quanto a água (sendo nesta última em quaisquer
proporções).
Já no caso da água existe um longo parêntese. Foi a única a desenvolver
um comportamento diferente. Não solubilizou a frio, mas solubilizou a quente.
Tal característica diferente já era de se esperar, visto que além de ser uma
substância inorgânica, a mesma não possui parte apolar. Ou seja, a molécula é
totalmente polar, possuindo apenas ligações de hidrogênio com outras moléculas do próprio solvente. Ao adicionar água ao ácido benzoico a frio pôde-se perceber quase nenhuma
solubilidade visto que o ácido benzoico possui uma longa parte apolar
representada pela cadeia carbônica. Tal fato impede a interação soluto-solvente
entre o último e o primeiro. No entanto, o ácido benzoico também possui uma
parte polar (grupo carboxílico). Isso quer dizer que sua solubilidade pode ser facilitada com o aquecimento do
sistema, fazendo com que as ligações intermoleculares entre as cadeias carbônicas
das moléculas de ácido benzoico fiquem mais fracas e as ligações de
hidrogênio entre as moléculas da água e do soluto ficassem mais fortes,
promovendo assim, a dissolução completa e, por conseguinte, a solvatação das moléculas
do soluto pelas do solvente.
·
5.2 - Recristalização
Como a
recristalização (processo de purificação de um sólido através da formação de
cristais) se deu em etapas, os resultados e discussões também serão:
· Pesagem do sólido e do papel qualitativo
· Pesagem do sólido e do papel qualitativo
Tal
pesagem aconteceu para efeitos comparativos e determinação do rendimento. Tal
parte será esclarecida melhor adiante. A partir da balança analítica
obtiveram-se as seguintes medidas:
-
Estimativa pretendida de ácido benzoico impuro: 2g
-
Quantidade de ácido benzoico impuro na prática: 1,9992g
- Papel
de filtro qualitativo: 1,0022g
Obs: A
pesagem do ácido benzoico foi feita com auxílio de um vidro de relógio.
Figura 6. Ácido benzoico impuro
A maior evidência de que o ácido
benzoico estava impuro como pode-se ver acima é que ele não estava branco, que
nem na descrição feita na introdução deste relatório.
· Dissolução a quente
· Dissolução a quente
Como já
esperado e testado anteriormente, o ácido benzoico dissolveu muito pouco a
frio, mas totalmente a quente, como pode ser analisado nas imagens a seguir:
Figura 7. Ácido benzoico em água destilada a frio e
a quente, respectivamente.
A
dissolução em um solvente na recristalização representa na verdade uma primeira
separação do sólido de suas impurezas, visto que no momento que o ácido
benzoico é dissolvido, grande parte das suas impurezas ficam boiando.
Como na prática não permaneceu nenhuma
impureza colorida no líquido, não foi necessária a utilização de carvão ativado.
Aconteceu uma pequena adaptação nessa
etapa. Visto que não haviam placas de aquecimento suficientes, necessitou-se
colocar o funil sem bico para a filtração por gravidade no topo do erlenmeyer
para que o vapor liberado pela água o aquecesse.
Também foi notado nessa parte muito
desperdício por inexperiência na transferência do ácido benzoico que estava no
vidro de relógio para o erlenmeyer. Outro desperdício foi caracterizado também por
pequenas partículas do ácido benzoico ficarem nas paredes do erlenmeyer ao
invés de se misturarem com a água. Mesmo molhando com pisseta, o sólido voltava
para as paredes. E, por último, também foi notado que no momento em que a água
começou a evaporar, algumas partículas do ácido benzoico começaram a sair do
erlenmeyer, pipocando e caracterizando perda de material.
- Filtração a quente, repouso e resfriamento
Após montar o sistema de
filtração simples (por gravidade), filtrou-se o sistema e impurezas insolúveis
foram separadas da mistura homogênea de água e ácido benzoico. Um fator a se
ponderar é que a filtração teve de ser com um funil quente e sem bico para que
os cristais não fossem formados assim que a mistura entrasse em contato com ele
e com a sua parte fria, que é o bico.
Depois da filtração simples*, a
mistura foi deixada em repouso e com um vidro de relógio acima do segundo
erlenmeyer.
Figura 8. Erlenmeyer após a filtração. Coloca-se um
vidro de relógio para que os odores não sejam inalados.
Depois de certo tempo, analisou-se a
presença de formação de cristais no fundo da mistura, característica essa já
esperada visto que o ácido benzoico não é um sólido amorfo e possui retículo
cristalino regular:
Figura 9. Formação dos cristais no fundo do erlenmeyer
Após isso, colocou-se o erlenmeyer em
um banho de gelo (béquer largo contendo 2 dedos de água e 7 cubos de gelo) para
que o resfriamento acontesse de forma lenta e o tamanho dos cristais não fosse
afetado, nem suas formas. Um exemplo que pode ser citado é o das estalagmites
de uma caverna glacial que, por permanecerem sem serem pertubadas, possuem
formas bem definidas. Isso acontece devido a velocidade do resfriamento. Quanto
mais se demora, mais tem corrente de ar e mais os cristais ficam bem modelados.
·
- Filtração a Vácuo e Secagem
Depois da formação dos cristais
se tornou necessário separar
a água mãe
de recristalização (água + impurezas) do soluto (ácido benzoico). A técnica
mais rápida e eficaz para esse tipo de separação é a filtração a vácuo.
Somente
foi necessário entornar a mistura (no meio do papel de filtro para que os
cristais que ficam no fundo passem a ficar em suspensão) para que o sistema de
sucção rapidamente separasse a fase líquida da fase sólida. Enquanto a água-mãe
se depositou no Kitasato, os cristais do ácido benzoico (em seu estado puro:
forma de agulha e de cor branca) ficaram no papel de filtro, que foi retirado
do funil com a ajuda de uma pinça. Após isso, o papel de filtro contendo o
ácido benzoico foi guardado em um armário com identificação para sua secagem e
posterior uso na determinação do rendimento e ponto de fusão. OBS: A estufa não
foi utilizada pois o ácido benzoico é sublimável.
O “antes e depois” da prática pode ser
facilmente visualizado abaixo:
·
5.3 - Determinação
do Rendimento e do Ponto de Fusão
Para efeito quantitativo é de extrema importância o cálculo do rendimento e a mensuração do ponto de fusão (critério de pureza).
O rendimento pode ser facilmente obtido através da seguinte regra de três:
Massa total (Sólido com impurezas) -------- 100%
Massa dos cristais
--------------------------------- x
Como o sólido no momento em que foi guardado após a recristalização estava sob um papel qualitativo,antes de submeter ao processo de recristalização teve-se que pesar ambos para posterior substração. Isso foi feito para que no momento em que se pesasse o conjunto após a recristalização (cristais + papel de filtro), a massa do papel de filtro fosse desconsiderada.
Relembrando os dados tomados na pesagem
anterior:
-
Quantidade de ácido benzoico impuro: 1,9992g
- Papel
de filtro qualitativo: 1,0022g
Juntando com o peso dos cristais junto com
o papel de filtro após a secagem:
-
Cristais junto com papel de filtro: 2,5693g
Obteve-se os seguintes resultados:
- Subtraindo a massa do cristal com o papel de
filtro da massa somente do papel de filtro, tem-se:
2,5693g – 1,0022g = 1,5671g
Ou seja: 1,5671g é a massa somente dos cristais.
Como a massa inicial do ácido benzoico (quando
estava impuro) era 1,9992g, houve uma perda caracterizada pela subtração da
massa inicial pela final:
1,9992g – 1,5671g = 0,4321g
Ou seja: 0,4321g foi a quantidade desperdiçada,
remetendo-se ao explanado nas páginas 14 e 15. Essa quantidade também pode ser
a massa das impurezas contidas no ácido.
Para calcular o rendimento utilizou-se citada acima.
Sendo assim, substituindo-se:
1,9992g --- 100%
1,5671g --- X
1,9992x = 1,5671 . 100
1,9992x = 156,71
X = 156,71 / 1,9992
X = 78,386354%
A partir dos cálculos dá-se a entender
que o processo de recristalização efetuado obteve um rendimento de
aproximadamente 78,39%.
Através do método de
Siwoloboff utilizado de modo similar anteriormente para a ebulição, o ponto de
fusão foi determinado como critério de pureza. Uma substância pura possui ponto
de fusão bem definido, com variação de no máximo 1 a 2 graus pra cima. Sendo
assim, foi analisado o ácido benzoico, substância resultante da recristalização
feita previamente.
Para que
o cristal pudesse caber dentro do tubo capilar foi necessário pulverizá-lo com
o pistilo. Como o objetivo era tomar duas temperaturas específicas: a do início
da fusão (momento em que o primeiro cristal do solido se funde) e a do final da
fusão (momento em que todo o cristal se funde), o processo de microdeterminação
foi feito duas vezes e fez-se a média das temperaturas. Tais temperaturas
específicas representam a faixa de fusão de um sólido.
Como se
trata de um banho de aquecimento de glicerina, os mesmo cuidados feitos nas
outras práticas foram reproduzidos nessa: anel de borracha esteve acima do
banho e o tubo capilar junto ao bulbo do termômetro (obs: o tubo capilar não
fica dentro de um tubo de ensaio como na ebulição).
A
partir do vivido na prática observou-se que as seguintes temperaturas estavam
na provável faixa de fusão.
TABELA 5. Obtenção da
faixa de fusão do ácido benzoico
1ª tentativa
|
2ª tentativa
|
|
Momento em que o primeiro cristal se
funde
|
121ºC
|
122ºC
|
Momento em que todo o cristal se
funde
|
122ºC
|
122,5ºC
|
Média inicio –
121,5ºC
Média final –
122,25ºC
Como pode-se ver, em ambos os casos o
intervalo da faixa de fusão deu menos ou igual a 1 grau Celsius e sempre próximo
do ponto de fusão descrito na literatura (122ºC). Fez-se as médias e descobriu-se
que a faixa de fusão real é 122-122,5ºC. Determinou-se então que o ácido
benzoico, resultado da recristalização, seja considerado como substância
efetivamente purificada.
6.
Conclusão
A partir
do observado pôde-se perceber que apesar da recristalização ser um processo de
purificação efetivo direcionado aos sólidos verdadeiros, é um prcesso demorado, que necessita de uma
grande quantidade de equipamentos e leva a um desperdício muito grande de
solventes e de soluto (evidenciado através do cálculo do rendimento). Não
deve-se utilizar para substâncias caras e análises qulmicas quantitativas.
6.
Anexos
Imagem cedida pelo professor Paulo Daniel Silva
Figura 11. Sistema
de Microdeterminação do Ponto de Fusão utilizada para avalização da Pureza do
Ácido Benzoico. Não utilizou-se o tubo de ensaio na prática.
Figura 12. Sistema de Filtração a Vácuo. Aconselha-se a
usar um frasco de segurança tampado com uma rolha.
Figura 13. Filtração simples com funil sem colo. O
filtro precisa estar quente para que os cristais não sejam formados durante a
filtração.
Figura 14. Exemplos de três solventes comuns. A partir
dos conceitos expostos sobre recristalização pode-se perceber que o melhor
solvente para tal técnica é o solvente B, pois dissolve mais a quente do que a
frio.
8.
Referências
·
Roteiro
de Prática de Química Orgânica – “Experimento 2: Purificação de Compostos
Orgânicos – Recristalização” cedida pelo professor Paulo Daniel Silva durante o
ano letivo de 2012.1 em 26/03/2012 no Instituto Federal de Educação, Ciência e
Tecnologia da Bahia.
·
Aula
de Pré-laboratório sobre Recristalização apresentada pela professora Edeilza
Lopes dos Santos no dia 2 de abril de 2012 no Instituto Federal de Educação,
Ciência e Tecnologia da Bahia.
·
Aula
de Pré-laboratório sobre Ponto de Fusão apresentada pelo professor Paulo Daniel
Silva no dia 23 de abril de 2012 no Instituto Federal de Educação, Ciência e
Tecnologia da Bahia.
·
FELTRE,
Ricardo. Química Geral – Volume 1, 6ª edição, São Paulo, Editora Moderna, 2004.
Págs: 29 e 30.
·
DIAS,
Ayres Guimarães, COSTA, Marco Antônio da e GUIMARÃES, Pedro Ivo Canesso. Guia
Prático de Química Orgânica Volume 1, Edição Única, Rio de Janeiro, Editora
Interciência, 2004. Pág:62, 63 e 90 a 94.